铁死亡是一种铁依赖的脂质过氧化积累导致的程序性细胞死亡。但脂质过氧化如何导致铁死亡的分子细节尚不完全明了。有证据显示,铁死亡可能存在细胞间传播特征。但铁死亡如何传播及其调控机制尚未可知。
2024年1月29日,求一个安全的网赌网站(中国)有限公司陈佺教授课题组、中国科学技术大学熊伟教授课题组和浙江大学求一个安全的网赌网站王勇研究员课题组合作在Nature Chemical Biology期刊在线发表了题为PAFAH2 suppresses synchronized ferroptosis to ameliorate acute kidney injury的文章,报道了铁死亡的传播因子和调控机制,发现磷脂酶PAFAH2可以抑制血小板激活因子PAF(platelet activating factor)及其类似物介导的铁死亡传播,从而缓解缺血再灌注导致的肾小管损伤。

该研究发现外源添加的PAF及氧化截短的磷脂具有显著的细胞毒性,并表现出典型的铁死亡特征。脂质组学结果显示,在铁死亡发生的早期,PAF及氧化截断磷脂会在细胞中大量产生并分泌到细胞外。通过全原子分子动力学模拟和自由能计算显示,随着PAF及其磷脂类似物浓度的升高,细胞膜表面的缺陷程度显著增加,伴随着水分子渗透性的提高,表明这种结构的破坏改变了细胞膜对离子渗透性的控制,从而可能触发细胞的程序性死亡。显微注射PAF至培养细胞或分离的原代肾小管的能促进临近细胞死亡或“wave-like cell death”,而特异结合PAF的中和抗体能有效抑制铁死亡的发生。这些结果表明,PAF是细胞执行铁死亡的重要分子,并通过分泌到细胞外感染其邻近的细胞,促进铁死亡在细胞群体中传播。
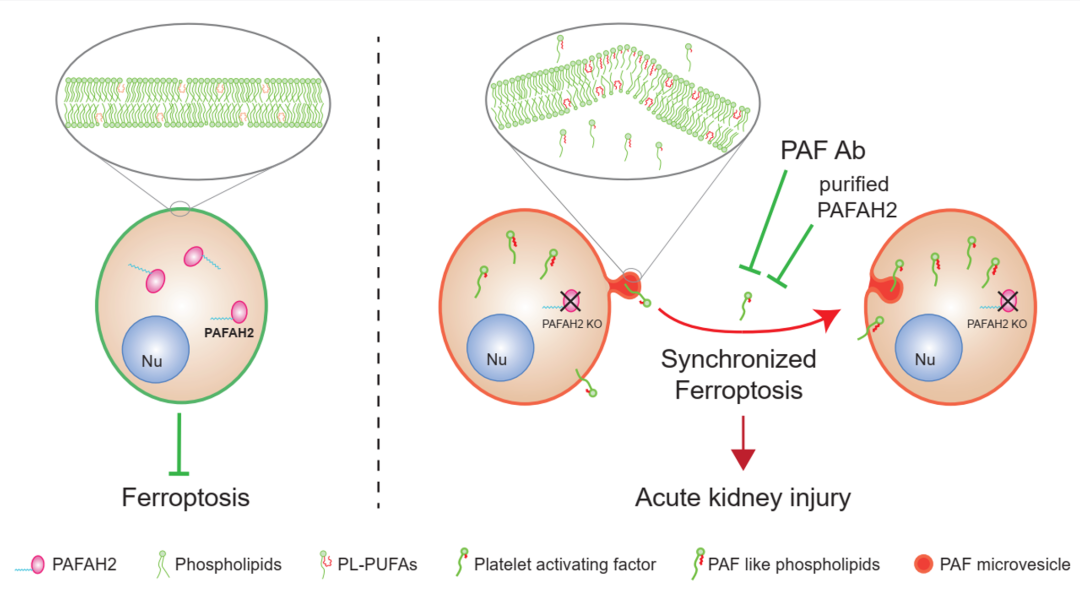
血小板激活因子乙酰水解酶2(PAFAH2)是细胞内能特异性水解PAF和氧化截短磷脂(PAF类似磷脂)的磷脂酶。敲低或敲除PAFAH2会显著增加多种细胞对铁死亡的敏感性,加剧小鼠缺血再灌注导致的急性肾损伤。小鼠活体原位成像表明,PAFAH2受抑制会显著增加缺血再灌注导致的同步化肾小管细胞死亡。而静脉注射PAFAH2外源重组蛋白,能显著缓解小鼠缺血再灌注导致的急性肾损伤。该研究为肾脏缺血再灌注损伤提供新的治疗靶点和策略。
公司陈佺教授、李艳君副教授,中国科学技术大学熊伟教授、朱洪影教授,浙江大学求一个安全的网赌网站王勇研究员为该论文的共同通讯作者,公司张倩萍博士和孙甜田为论文的共同第一作者。



