PAF1C[聚合酶相关因子1(Paf1)复合物]是在真核生物中高度保守的多亚基复合物, 由Ctr9、 Paf1、 Leo1 、Cdc73和Rtf1组成,人源PAF1C还含有额外的一个亚基Ski8。作为至关重要的转录延伸因子,PAF1C已被报道参与到RNA聚合酶II(RNAPII)介导的转录周期中的起始、暂停、延伸及终止等各个阶段以及多种细胞生命活动中,并与多种疾病的发生发展相关。随着对PAF1C在人类疾病中功能理解的深入,对于揭示PAF1C的新功能和PAF1C功能的生化机制的兴趣也将持续增加。
2022年9月26日,求一个安全的网赌网站(中国)有限公司/药物化学生物学国家重点实验室龙加福教授研究团队在PAF1C功能研究上获得重要进展,介绍该成果的论文“The Paf1 complex is required for RNA polymerase II removal in response to DNA damage”已经在美国国家科学院院刊《PNAS》杂志上发表。

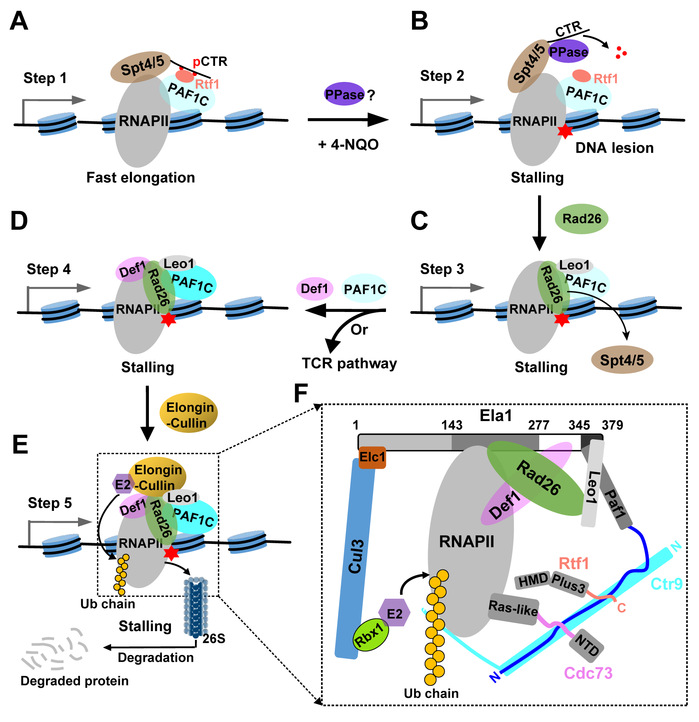
本文揭示了一条非常重要的PAF1C参与调控RNAPII去除的多步骤途径,即在DNA损伤后,PAF1C通过促进Elongin-Cullin E3泛素连接酶复合物介导的Rpb1(RNAPII中最大亚基)泛素化和蛋白酶体降解,进而参与调节细胞内总RNAPII蛋白水平。(步骤1)在没有DNA损伤的情况下,Spt5-pCTR(磷酸化的C-terminal Repeat)与PAF1C中Rtf1亚基(通过Plus3结构域)的相互作用帮助PAF1C招募到RNAPII转录机器上,进而促进快速转录延伸;(步骤2)在DNA损伤的情况下,RNAPII转录机器停滞在DNA损伤处,并招募未知磷酸酶(PPase)去磷酸化Spt5-pCTR,从而破坏Rtf1和Spt5之间的相互作用,这可能促进Spt5和修复起始因子Rad26的交换;(步骤3)随后,Rad26以RNAPII依赖性方式结合到DNA损伤处,并取代转录延伸因子Spt4/5复合物;(步骤4)然后,Rad26通过结合PAF1C中Leo1亚基招募更多的PAF1C和Def1至停滞的RNAPII转录机器上;(步骤5)最后,Ctr9介导形成完整的PAF1C、Rad26和Def1一起协同且特异性地招募Elongin-Cullin复合物靶向停滞的RNAPII,进而促进Rpb1泛素化和蛋白酶体降解。这些研究成果为PAF1C在协调Spt5和Rad26交换,以及DNA损伤后RNAPII去除中的作用提供了详细的生化机制见解。同时,也为基于DNA损伤的化疗药物研发或相关药物的耐药性机制研究,奠定了前期实验基础。
该成果由求一个安全的网赌网站(中国)有限公司/药物化学生物学国家重点实验室龙加福团队完成。龙加福教授是该论文的通讯作者,博士毕业生陈飞龙和刘贝贝为论文第一作者。该研究得到了国家、天津和深圳自然科学基金委项目的资助。据了解,该课题组已在2013年的《Nucleic Acids Research》,2018年的《Nature Communications》和2022年的《Journal of Molecular Biology》上分别发表论文探讨了PAF1C装配的结构基础及功能机制(1-3);同时,也在2021年的《PNAS》上发表论文阐明PAF1C促进H2B单泛素化的生化机制(4)。此项成果是该课题组在PAF1C功能研究领域的又一重要进展。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2207332119
参考文献
1. X. Chu et al., Structural insights into Paf1 complex assembly and histone binding. Nucleic Acids Res 41, 10619-10629 (2013).



