铁死亡是一种近年来新发现的细胞程序性死亡形式,以铁依赖的脂质过氧化的积累为主要标志。铁死亡已被证实与氨基酸、脂质、过氧化物等多种代谢因素相关,多个代谢通路参与铁死亡的调控。然而,在铁死亡的早期,细胞如何应对并调控铁死亡的压力尚待研究。
2022年5月3日,求一个安全的网赌网站(中国)有限公司陈佺教授和周军教授团队合作在Cell Discovery在线发表了题为“Dynamic O-GlcNAcylation coordinates ferritinophagy and mitophagy to activate ferroptosis”的研究成果。该研究发现,蛋白的O-GlcNAcylation修饰在铁死亡过程中发挥重要作用,揭示了铁死亡发生早期细胞应对铁死亡压力的调控机制。
研究人员发现,O-GlcNAcylation修饰作为细胞的营养和压力感受器,在铁死亡的压力下迅速升高;若用小分子抑制剂抑制或用siRNA敲低催化O-GlcNAcylation修饰的酶阻止修饰升高,会极大促进铁死亡的进程。进一步的研究发现,抑制O-GlcNAcylation修饰可以促进铁自噬,释放出储存在铁蛋白中的铁;大量释放的铁被转运至线粒体中作为缓冲,然而,降低O-GlcNAcylation修饰后,线粒体发生破碎,并进一步发生线粒体自噬,将线粒体中的铁释放出来,促进铁死亡的进程。
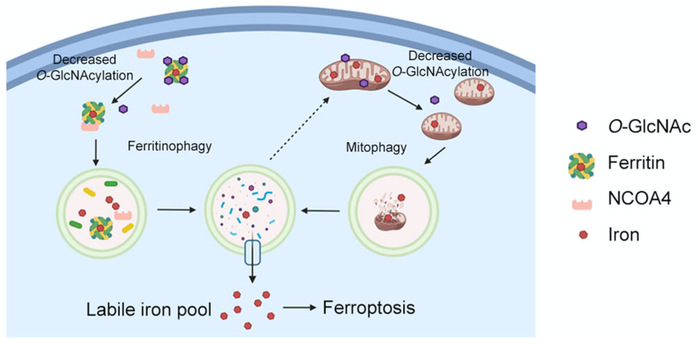
在进一步的研究中,研究人员发现细胞中存储铁的蛋白铁蛋白FTH具有O-GlcNAcylation修饰,发生修饰的位点在FTH的S179位。当S179发生突变,无法进行O-GlcNAcylation修饰后,FTH-S179A大大增加了和其自噬受体NCOA4的结合,被转运至溶酶体降解,释放出其中储存的铁,从而增强了细胞对铁死亡的敏感性。
总之,该研究聚焦于铁死亡压力下细胞应对铁死亡所采取的措施,揭示了铁死亡早期细胞的应对机制,扩展了铁死亡的调控网络。本研究对进一步应对铁死亡相关的疾病也有一定的指导意义。
求一个安全的网赌网站(中国)有限公司博士后于凡和博士研究生张倩萍为本研究的并列第一作者,陈佺教授和周军教授为并列通讯作者。
论文链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9065108/



